Chapter 2- अम्ल, क्षारक एवं लवण
MP Board Class 10th Science Chapter 2 पाठ के अन्तर्गत के प्रश्नोत्तर
पृष्ठ संख्या 20
प्रश्न 1.
आपको तीन परखनलियाँ दी गई हैं। इनमें से एक में आसवित जल एवं शेष दो में से एक में अम्लीय विलयन तथा दूसरे में क्षारीय विलयन है। यदि आपको केवल लाल लिटमस पत्र दिया जाता है, तो आप प्रत्येक परखनली में रखे गए पदार्थों की पहचान कैसे करेंगे?
उत्तर:
हम दिए गए लाल लिटमस पत्र के तीन भाग कर देंगे और प्रत्येक परखनली में एक – एक भाग डुबोयेंगे जो लिटमस नीला हो जाएगा उसमें क्षारीय विलयन होगा, उसे पृथक् कर लेंगे। शेष दोनों परखनलियों में से एक में अम्लीय विलयन तथा दूसरी में आसवित जल होगा। क्षारीय विलयन वाली परखनली से नीले लिटमस को निकालकर दो भाग करके शेष दोनों परखनियों में एक – एक भाग डुबोयेंगे जिस परखनली का लिटमस पत्र पुनः लाल हो जाता है उसका विलयन अम्लीय होगा तथा दूसरी परखनली का आसुत जल। इस प्रकार तीनों विलयनों का परीक्षण कर लेंगे।
पृष्ठ संख्या 24
प्रश्न 1.
पीतल एवं ताँबे के बर्तनों में दही एवं खट्टे पदार्थ क्यों नहीं रखने चाहिए?
उत्तर:
दही एवं खट्टे पदार्थों में अम्ल होते हैं। ये पीतल से अभिक्रिया करके जिंक एवं कॉपर के तथा कॉपर, ताँबे से क्रिया करके कॉपर के लवण बनाते हैं जो विषाक्त होते हैं। इसलिए पीतल एवं ताँबे के बर्तनों में दही एवं खट्टे पदार्थ नहीं रखने चाहिए।
प्रश्न 2.
धातु के साथ अम्ल की अभिक्रिया होने पर सामान्यतः कौन – सी गैस निकलती है? एक उदाहरण के द्वारा समझाइए। इस गैस की उपस्थिति की जाँच आप कैसे करेंगे?
उत्तर:
धातु के साथ अम्ल की अभिक्रिया होने पर प्रायः हाइड्रोजन (H2) गैस निकलती है।
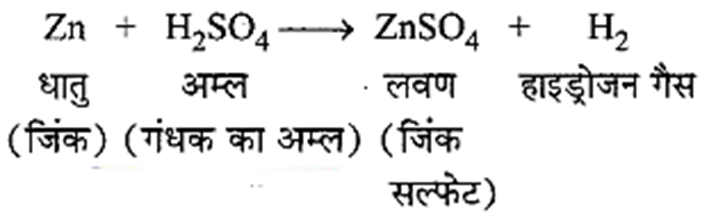
जब हम जलती हुई तीली इस गैस के पास लाते हैं तो यह फट – फट की ध्वनि के साथ जलती है।
प्रश्न 3.
कोई धातु यौगिक ‘A’ तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करता है तो बुदबुदाहट उत्पन्न होती है। इससे उत्पन्न गैस जलती मोमबत्ती को बुझा देती है। यदि उत्पन्न यौगिकों में से एक कैल्सियम क्लोराइड है, तो इस अभिक्रिया के लिए एक संतुलित रासायनिक समीकरण लिखिए।
उत्तर:
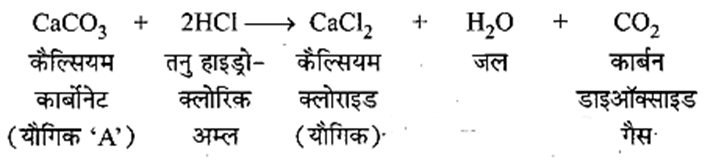
प्रश्न 1.
HCl, HNO3 आदि जलीय विलयन में अम्लीय अभिलक्षण क्यों प्रदर्शित करते हैं, जबकि ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों के विलयनों में अम्लीयता के अभिलक्षण प्रदर्शित नहीं होते हैं?
उत्तर:
HCl एवं HNO3 आदि जलीय विलयन में आयनित होकर हाइड्रोजन आयन (H+) अथवा हाइड्रोनियम आयन (H3O+) बनाते हैं जिसके कारण विलयन में अम्लीयता के अभिलक्षण प्रदर्शित होते हैं, जबकि ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिक आयनित नहीं होते। इसलिए उनके विलयन में अम्लीयता के अभिलक्षण प्रदर्शित नहीं होते।
प्रश्न 2.
अम्ल का जलीय विलयन क्यों विद्युत् का चालन करता है?
उत्तर:
अम्ल के जलीय विलयन में हाइड्रोजन आयन (H+) उत्पन्न होते हैं जो विद्युत् के वाहक होते हैं। इस कारण वे विद्युत् का चालन करते हैं।
प्रश्न 3.
शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र का रंग क्यों नहीं बदलती?
उत्तर:
शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस के साथ हाइड्रोजन आयन (H+) नहीं बनाती। इस कारण उसका रंग नहीं बदलती है।
प्रश्न 4.
अम्ल को तनुकृत करते समय यह क्यों अनुशंसित करते हैं कि अम्ल को जल में मिलाना चाहिए न कि जल को अम्ल में?
उत्तर:
अम्ल का तनुकरण एक अत्यन्त ऊष्माक्षेपी अभिक्रिया है तथा इसमें अत्यधिक मात्रा में ऊष्मा उत्पन्न होती है। अम्ल को जल में मिलाने पर जो ऊष्मा उत्पन्न होती जाती है वह जल द्वारा शोषित कर ली जाती है। इसलिए अम्ल को तनुकृत करने के लिए इसे जल में मिलाते हैं।
प्रश्न 5.
अम्ल के विलयन को तनुकृत करते समय हाइड्रोनियम आयन (H3O+) की सान्द्रता कैसे प्रभावित हो जाती है?
उत्तर:
अम्ल के विलयन को तनुकृत करते समय हाइड्रोनियम आयन (H3O+) की सान्द्रता प्रति इकाई आयतन कम हो जाती है।
प्रश्न 6.
जब सोडियम हाइड्रॉक्साइड विलयन में आधिक्य क्षारक मिलाते हैं तो हाइड्रॉक्साइड आयन (OH–) की सान्द्रता कैसे प्रभावित होती है?
उत्तर:
जब सोडियम हाइड्रॉक्साइड विलयन में आधिक्य क्षारक मिलाते हैं तो विलयन में हाइड्रॉक्साइड आयन (OH–) की सान्द्रता प्रति इकाई आयतन बढ़ जाती है।
NCERT Science Book Solution For Class 10 Hindi Medium
पृष्ठ संख्या 31
प्रश्न 1.
आपके पास दो विलयन ‘A’ और ‘B’ हैं। विलयन ‘A’ के pH का मान 6 है एवं विलयन ‘B’ के pH का मान 8 है। किस विलयन में हाइड्रोजन आयन की सान्द्रता अधिक है? इनमें से कौन अम्लीय है और कौन क्षारकीय?
उत्तर:
विलयन ‘A’ में हाइड्रोजन आयन (H+) की सान्द्रता अधिक होगी। विलयन ‘A’ अम्लीय विलयन है तथा विलयन ‘B’ क्षारकीय विलयन है।
प्रश्न 2.
H+(aq) आयन की सान्द्रता का विलयन की प्रकृति पर क्या प्रभाव पड़ता है?
उत्तर:
H+(aq) आयन की सान्द्रता बढ़ने पर विलयन को अम्लीय प्रकृति (अम्लीयता) बढ़ती जाती है। जबकि H+ आयन की सान्द्रता कम होने पर क्षारकीय प्रकृति बढ़ती है।
प्रश्न 3.
क्या क्षारकीय विलयन में H+(aq) आयन होते हैं? अगर हाँ तो ये क्षारकीय क्यों होते हैं?
उत्तर:
हाँ, क्षारकीय विलयनों में भी H+(aq) आयन होते हैं, लेकिन उनमें H+(aq) आयनों की अपेक्षा OH–(aq) आयनों की सान्द्रता अधिक होती है। इसलिए वे क्षारकीय होते हैं।
प्रश्न 4.
कोई किसान खेत की मृदा की किस परिस्थिति में बिना बुझा हुआ चूना (कैल्सियम ऑक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चाक (कैल्सियम कार्बोनेट) का उपयोग करेगा?
उत्तर:
जब खेत की मृदा अधिक अम्लीय होगी तो उस स्थिति में किसान बुझा या बिना बुझा चूना या चाक का उपयोग करेगा।
पृष्ठ संख्या 36
प्रश्न 1.
CaOCl2 का प्रचलित नाम क्या है?
उत्तर:
विरंजक चूर्ण (ब्लीचिंग पाउडर)।
प्रश्न 2.
उस पदार्थ का नाम बताइए जो क्लोरीन से अभिक्रिया करके विरंजक चूर्ण बनाता है।
उत्तर:
बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड)।
प्रश्न 3.
कठोर जल को मृदु करने के लिए किस सोडियम यौगिक का उपयोग किया जाता है?
उत्तर:
सोडियम कार्बोनेट (धोने का सोडा)।
प्रश्न 4.
सोडियम हाइड्रोजन कार्बोनेट के विलयन को गर्म करने पर क्या होगा? इस अभिक्रिया के लिए रासायनिक समीकरण लिखिए।
उत्तर:
सोडियम हाइड्रोजन कार्बोनेट के विलयन को गर्म करने पर सोडियम कार्बोनेट का विलयन बनता है तथा कार्बन डाइऑक्साइड गैस निकलती है।
अभिक्रिया का रासायनिक समीकरण:
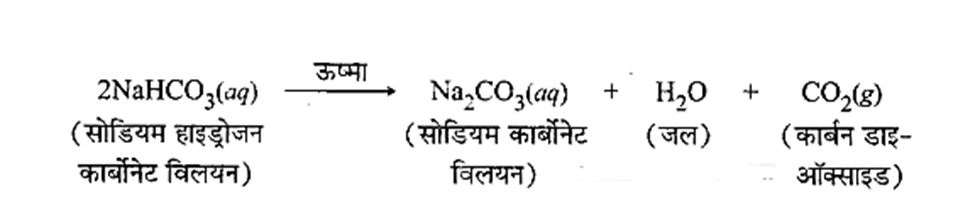
प्रश्न 5.
प्लास्टर ऑफ पेरिस की जल के साथ अभिक्रिया का समीकरण लिखिए।
उत्तर:
प्लास्टर ऑफ पेरिस की जल के साथ अभिक्रिया का समीकरण:
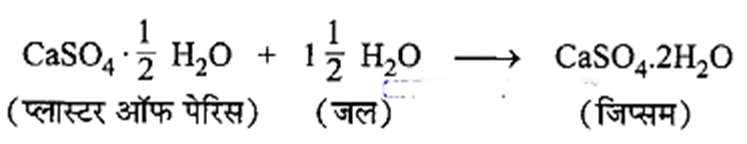
पाठान्त अभ्यास के प्रश्नोत्तर
प्रश्न 1.
कोई विलयन लाल लिटमस को नीला कर देता है, इसका pH सम्भवतः क्या होगा ?
(a) 1
(b) 4
(c) 5
(d) 10
उत्तर:
(d) 10
प्रश्न 2.
कोई विलयन अण्डे के पिसे हुए कवच से अभिक्रिया करके एक गैस उत्पन्न करता है, जो चने के पानी को दूधिया कर देती है। इस विलयन में क्या होगा?
(a) NaCl
(b) HCl
(c) LiCl
(d) KCl
उत्तर:
(b) HCl
प्रश्न 3.
NaOH का 10 ml विलयन HCl के 8 ml विलयन से पूर्ण उदासीन हो जाता है। यदि हम NaOH के उसी विलयन का 20 ml लें तो उसे उदासीन करने के लिए HCl के उसी विलयन की कितनी मात्रा की आवश्यकता होगी?
(a) 4 ml
(b) 8 ml
(c) 12 ml
(d) 16 ml
उत्तर:
(d) 16 ml
प्रश्न 4.
अपच का उपचार करने के लिए निम्न में से किस औषधि का उपयोग होता है?
(a) ऐण्टीबायोटिक (प्रतिजैविकी)
(b) ऐनालजेसिक (पीड़ाहारी)
(c) ऐन्टैसिड
(d) ऐन्टीसेप्टिक (प्रतिरोधी)
उत्तर:
(c) ऐन्टैसिड।
प्रश्न 5.
निम्नलिखित अभिक्रिया के लिए पहले शब्द समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिए –
(a) तनु सल्फ्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है।
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम पट्टी के साथ अभिक्रिया करता है।
(c) तनु सल्फ्यूरिक अम्ल ऐलुमिनियम चूर्ण के साथ अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लोह के चूर्ण के साथ अभिक्रिया करता है।
उत्तर:
शब्द समीकरण:

संतुलित समीकरण:
(a) Zn(s) + Dil. H2SO4(dil) → ZnSO4 (aq) + H2 ↑
(b) Mg(s) + 2HCl(dil) → MgCl2(aq) + H2 ↑
(c) 2Al(s) + 3H2SO4(dil) → Al2(SO4)3(aq) + 3H2 ↑
(d) Fe(s) + 2HCl (dil) → FeCl2(aq) + H2 ↑
प्रश्न 6.
ऐल्कोहॉल एवं ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होते हैं, लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे सिद्ध कीजिए।
उत्तर:
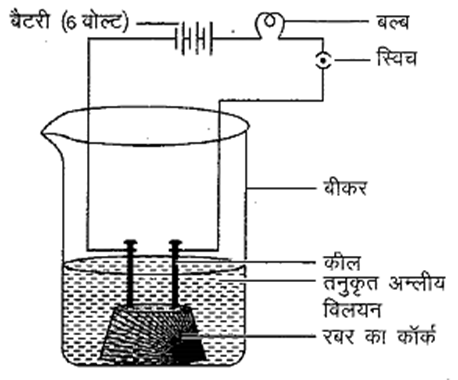
एक कॉर्क पर दो कीलें लगाकर संलग्न आकृति के अनुसार 100 ml के बीकर में रखकर कीलों को 6 V की एक बैटरी के दोनों टर्मिनलों के साथ एक बल्ब एवं स्विच के माध्यम से जोड़ दीजिए।
- अब बीकर में थोड़ा तनु HCl डालकर विद्युत् धारा बीकर प्रवाहित कीजिए आप देखेंगे कि बल्ब जल जाता है।
- अब इस प्रयोग को तनु H2SO4 डालकर दोहराइए कील तनुकृत अम्लीय तो आप देखेंगे कि बल्ब पुनः जल जाता है।
- आप बारी – बारी से इस प्रयोग को ग्लूकोज विलयन एवं ऐल्कोहॉल विलयन के साथ भी दोहराइए। आप देखेंगे कि इनमें से किसी भी अवस्था में बल्ब नहीं जलता।
निष्कर्ष:
इससे स्पष्ट होता है कि अम्लों के विलयन विद्युत् धारा के चालक होते हैं जबकि ग्लूकोज एवं ऐल्कोहॉल के विलयन विद्युत् धारा के चालक नहीं होते और इसलिए इन्हें अम्लों की श्रेणी में विभाजित नहीं करते।
ज्ञातव्य: अम्ल नीले लिटमस को लाल कर देते हैं, लेकिन ऐल्कोहॉल एवं ग्लूकोज के विलयन नहीं करते, इससे भी सिद्ध होता है कि ऐल्कोहॉल एवं ग्लूकोज में हाइड्रोजन होते हुए भी ये अम्ल की श्रेणी में नहीं आते।
प्रश्न 7.
आसवित जल विद्युत् का चालक क्यों नहीं होता, जबकि वर्षा का जल होता है?
उत्तर:
आसवित जल में हाइड्रोजन आयन (H+) अथवा हाइड्रॉक्साइड आयन (OH–) नहीं होते जो विद्युत् के वाहक होते हैं। इसलिए आसवित जल विद्युत का चालक नहीं होता। वहीं दूसरी ओर वर्षा जल में कुछ अम्ल की मात्रा मिली होती है जो हाइड्रोजन आयन (H+) देती है, इसलिए वर्षा जल विद्युत् का चालक होता है।
प्रश्न 8.
जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता?
उत्तर:
जल की अनुपस्थिति में अम्ल हाइड्रोजन आयन (H+) नहीं देते जो अम्लीय व्यवहार के कारक है। इसलिए जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय नहीं होता है।
प्रश्न 9.
पाँच विलयनों A, B, C, D एवं E की जब सार्वत्रिक सूचक से जाँच की जाती है, तो pH के मान क्रमशः 4, 1, 11, 7 एवं 9 प्राप्त होते हैं, कौन – सा विलयन?
(a) उदासीन है।
(b) प्रबल क्षारीय है।
(c) प्रबल अम्लीय है।
(d) दुर्बल अम्लीय है।
(e) दुर्बल क्षारीय है।
उत्तर:
(a) विलयन ‘D’ उदसीन है। (pH = 7)
(b) विलयन ‘C’ प्रबल क्षारीय है (pH = 11)
(c) विलयन ‘B’ प्रबल अम्लीय है। (pH = 1)
(d) विलयन ‘A’ दुर्बल अम्लीय है। (pH = 4) एवं
(e) विलयन ‘E’ दुर्बल क्षारीय है। (pH = 9)
इन pH मानों को हाइड्रोजन आयनों की सान्द्रता के बढ़ते क्रम में व्यवस्थित कीजिए।
प्रश्न 10.
परखनली ‘A’ एवं ‘B’ में समान लम्बाई की मैग्नीशियम की पट्टी लीजिए। परखनली ‘A’ में हाइड्रोक्लोरिक अम्ल (HCl) तथा परखनली ‘B’ में ऐसीटिक अम्ल (CH3COOH) डालिए। दोनों अम्लों की मात्रा तथा सान्द्रता समान है। किस परखनली में अधिक तेजी से बुदबुदाहट होगी और क्यों?
उत्तर:
परखनली ‘A’ में अधिक तेजी से बुदबुदाहट होगी क्योंकि इसमें हाइड्रोक्लोरिक अम्ल है जो ऐसीटिक अम्ल से बहुत अधिक प्रबल है।
प्रश्न 11.
ताजे दूध का pH मान 6 होता है। दही बन जाने पर इसके pH के मान में क्या परिवर्तन होगा? अपना उत्तर समझाइए।
उत्तर:
दही बन जाने पर दूध का pH मान घट जाएगा, क्योंकि दही में अम्ल होता है जिससे दूध में हाइड्रोजन आयनों (H+) का सान्द्रण बढ़ जाएगा।
प्रश्न 12.
एक ग्वाला ताजे दूध में थोड़ा बेकिंग सोडा मिलाता है –
- ताजा दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय क्यों बना देता है?
- इस दूध को दही बनने में अधिक समय क्यों लगता है?
उत्तर:
- बेकिंग सोडा क्षारीय (क्षारकीय) होता है जिसका pH मान 7 से अधिक होता है। इसको दूध (pH मान) में मिलाने से दूध का pH मान बढ़कर 7 से अधिक हो जाता है। इससे दूध क्षारीय हो जाता है।
- बेकिंग सोडा मिले दूध का pH मान साधारण दूध के pH मान से अधिक होता है। इसलिए दही बनने के लिए दूध को अधिक समय लगता है।
प्रश्न 13.
प्लास्टर ऑफ पेरिस को आर्द्र – रोधी बर्तन में क्यों रखा जाना चाहिए? इसकी व्याख्या कीजिए।
उत्तर:
प्लास्टर ऑफ पेरिस आर्द्रताग्राही होता है और आर्द्रता (नमी या जलवाष्प) से क्रिया करके कठोर ठोस पदार्थ का निर्माण करता है। इसलिए प्लास्टर ऑफ पेरिस को आर्द्र – रोधी बर्तन में रखा जाना चाहिए।
प्रश्न 14.
उदासीनीकरण अभिक्रिया क्या है? दो उदाहरण दीजिए।
उत्तर:
उदासीनीकरण:
“अम्ल और क्षारक परस्पर अभिक्रिया करके एक – दूसरे को उदासीन कर देते हैं और लवण एवं जल का निर्माण करते हैं। यह प्रक्रिया उदासीनीकरण कहलाती है।”
उदाहरण:
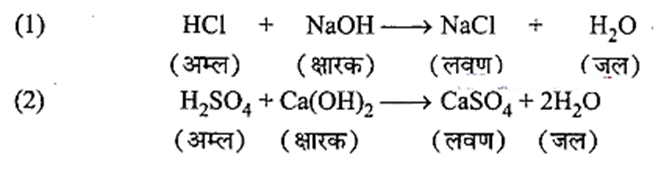
प्रश्न 15.
धोने का सोडा एवं बेकिंग सोडा के दो – दो प्रमुख उपयोग बताइए।
उत्तर:
धोने के सोडा के उपयोग:
- इसका उपयोग काँच, साबुन एवं कागज उद्योगों में होता है।
- इसका उपयोग घरों में साफ – सफाई के लिए होता है।
बेकिंग सोडा के उपयोग:
- इसका प्रमुख उपयोग बेकरी में उपयोग आने वाले बेकिंग पाउडर बनाने में होता है।
- इसका उपयोग सोडा – अम्ल अग्निशामक में किया जाता है।
NCERT Book Class 10th Science Solution Chapter 2- अम्ल, क्षारक एवं लवण